(GIÁO TRÌNH KHOA HỌC CƠ BẢN – TÀI LIỆU THAM KHẢO)
Bạn đã bao giờ tự hỏi: nguyên tử được tạo nên từ đâu, proton và neutron hình thành thế nào, hay tại sao lại có phản ứng hóa học?
Tài liệu “Cấu tạo, Phản ứng hóa học và Biến đổi Vật Chất” sẽ giúp bạn đi từ cái nhỏ nhất của vũ trụ – hạt cơ bản – cho đến nguyên tử, phân tử, chất, và các biến đổi hóa học trong đời sống hàng ngày.
Nội dung chính của giáo trình
- Hạt cơ bản và nguyên tử
- Giới thiệu về quark, gluon, proton, neutron, electron
- Bốn lực cơ bản: hấp dẫn, điện từ, hạt nhân mạnh, hạt nhân yếu
- Cơ học lượng tử và sự khác biệt với cơ học cổ điển
- Nguyên tử và hạt nhân
- Cấu tạo nguyên tử: hạt nhân (proton, neutron) và electron
- Lepton, neutrino và Higgs boson trong Mô hình Chuẩn
- Tính trung hòa điện và vai trò của số hiệu nguyên tử (Z)
- Phân tử – Liên kết hóa học – Trạng thái vật chất
- Phân tử là gì? Đặc điểm và cấu trúc
- Liên kết hóa học: cộng hóa trị, ion, kim loại, hydro
- Phân loại chất: đơn chất, hợp chất, kim loại, phi kim, á kim
- Các trạng thái: rắn, lỏng, khí, plasma và sự chuyển đổi
- Phản ứng hóa học và biến đổi vật chất
- Phản ứng tổng hợp, phân hủy, thế, trao đổi, oxi hóa – khử, hữu cơ
- Ứng dụng của phản ứng hóa học trong sản xuất và đời sống
- Khái niệm biến đổi vật chất và ví dụ thực tiễn
Vì sao bạn nên đọc tài liệu này?
- Khoa học phổ thông dễ hiểu: diễn giải rõ ràng, ví dụ trực quan, phù hợp học sinh – sinh viên – người yêu khoa học.
- Nội dung chuẩn mực: dựa trên vật lý – hóa học phổ thông và Mô hình Chuẩn hiện đại.
- Ứng dụng thực tế: giúp bạn hiểu bản chất của thế giới, từ cấu tạo nguyên tử đến phản ứng trong nấu ăn, y học và công nghệ.
📌 Xem toàn bộ giáo trình PDF trong khung bên dưới.
👉 Bản đầy đủ sẽ giúp bạn đi từ quark → proton → nguyên tử → phân tử → phản ứng hóa học → biến đổi vật chất, mở ra cái nhìn toàn diện về thế giới vi mô và vĩ mô.
NỘI DUNG RÚT GỌN CỦA TÀI LIỆU
1 PHẦN 1: HẠT CƠ BẢN → NGUYÊN TỬ
1.1 CẤU TẠO CỦA VẬT CHẤT
1.1.1 Cấu tạo vật chất
Vật chất là tất cả những gì có khối lượng và chiếm không gian. Ở cấp độ vi mô, nó được cấu tạo từ nguyên tử – đơn vị cơ bản nhất của nguyên tố hóa học. Nguyên tử gồm hạt nhân nằm ở trung tâm và các electron quay xung quanh.
Trong hạt nhân có proton và neutron, còn proton và neutron lại được tạo thành từ quark – những hạt sơ cấp nhỏ hơn nữa. Do đó, bậc thang cơ bản có thể hình dung như sau:
Quark → Proton/Neutron → Hạt nhân → Nguyên tử → Phân tử → Vật chất.
1.1.2 Vật lý hạt là gì?
Vật lý hạt là ngành khoa học nghiên cứu những hạt cơ bản và lực tương tác giữa chúng. Đây là lĩnh vực nền tảng giúp con người giải thích sự hình thành và tồn tại của vũ trụ từ cấp độ nhỏ nhất.
1.1.3 Công cụ nghiên cứu chính
Các hạt cơ bản thường tồn tại trong thời gian cực ngắn, chỉ có thể quan sát bằng máy gia tốc hạt. Máy này tạo ra các va chạm ở năng lượng rất lớn, làm lộ diện những hạt sơ cấp. Các máy dò hạt ghi lại quỹ đạo, năng lượng và tính chất của chúng để phân tích.
1.1.4 Thành tựu và giới hạn hiện nay
- Thành tựu: xây dựng Mô hình Chuẩn (Standard Model); phát hiện Higgs boson (2012); hiểu rõ 3/4 lực cơ bản trong tự nhiên.
- Giới hạn: chưa giải thích được vật chất tối, năng lượng tối và bản chất lực hấp dẫn ở cấp độ lượng tử.
- 1.1.5 Một số quy luật cơ học lượng tử
- Nguyên lý bất định Heisenberg: không thể xác định chính xác vị trí và vận tốc của hạt cùng lúc.
- Siêu vị trí (superposition): hạt có thể tồn tại ở nhiều trạng thái cùng lúc.
- Rối lượng tử (entanglement): hai hạt có thể liên thông thông tin tức thì, bất kể khoảng cách.
1.1.6 Sự khác biệt giữa cơ học cổ điển và cơ học lượng tử
- Cơ học cổ điển: mô tả vật thể vĩ mô, có quỹ đạo và vận tốc xác định.
- Cơ học lượng tử: mô tả thế giới vi mô, nơi hạt vừa là sóng vừa là hạt, hành vi mang tính xác suất.
1.2 CÁC QUARK – ĐƠN VỊ NHỎ NHẤT
1.2.1 Hạt Quark
Quark là hạt sơ cấp, được xem là điểm không có kích thước bên trong. Có 6 loại (up, down, strange, charm, bottom, top). Trong tự nhiên, quark up và down phổ biến nhất, vì chúng tạo thành proton và neutron – nền tảng của nguyên tử.
1.2.2 Lực gắn kết: hạt Gluon
1.2.2.1 Hạt gluon – hạt trung gian truyền lực
Gluon mang lực tương tác mạnh, lực mạnh nhất trong tự nhiên. Chính nhờ gluon mà các quark gắn kết với nhau để tạo thành hạt ổn định.
1.2.2.2 Các cách kết hợp Quark
- Baryon: gồm 3 quark (proton = uud, neutron = udd).
- Meson: gồm 1 quark và 1 phản quark (pion, kaon).
1.2.3 Đặc điểm chung của Quark
- Có “màu sắc” (color charge) – khái niệm trong vật lý hạt.
- Không tồn tại tự do, luôn bị “giam hãm” trong hạt lớn hơn.
- Được gắn kết bởi gluon.
1.3 PROTON – NEUTRON – HẠT CƠ BẢN TRONG HẠT NHÂN
1.3.1 Hạt Proton và Neutron là gì?
- Proton: điện tích +1, gồm 2 quark up và 1 quark down.
- Neutron: trung hòa điện, gồm 1 quark up và 2 quark down.
1.3.2 Cấu trúc bên trong proton và neutron
Bên trong proton/neutron, ba quark không hề tĩnh mà dao động liên tục, được gluon kết nối. Ngoài 3 quark chính, còn tồn tại mây gluon và quark ảo xuất hiện – biến mất liên tục.
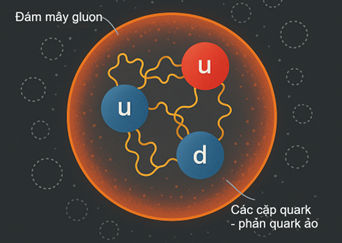 Mô phỏng lượng tử của proton
Mô phỏng lượng tử của proton
1.3.3 Tưởng tượng trực quan
Hãy hình dung proton như một quả bóng nhỏ, trong đó ba quark như những hạt bụi siêu nhỏ, luôn chuyển động. Gluon giống những sợi dây đàn năng lượng nối chúng lại.
1.3.4 Bốn lực cơ bản trong tự nhiên
- Lực hấp dẫn.
- Lực điện từ.
- Lực hạt nhân mạnh.
- Lực hạt nhân yếu.
1.4 NGUYÊN TỬ – NUCLEUS
1.4.1 Nguyên tử là gì?
Nguyên tử là đơn vị nhỏ nhất vẫn giữ nguyên tính chất hóa học. Nó gồm hạt nhân (proton + neutron) và electron quay quanh.
1.4.2 Hạt nhân nguyên tử – Trái tim của nguyên tử
Hạt nhân chứa gần như toàn bộ khối lượng của nguyên tử. Proton vốn cùng điện tích nên đẩy nhau, nhưng nhờ lực hạt nhân mạnh, chúng vẫn gắn kết chặt chẽ.
1.4.3 Lepton
Lepton gồm electron, muon, tau và neutrino. Đây là nhóm hạt không chịu lực hạt nhân mạnh.
1.4.4 Electron
Electron mang điện tích âm, quyết định tính chất hóa học và liên kết giữa các nguyên tử.
1.4.5 Neutrino – Hạt ma
Neutrino cực kỳ nhẹ, không mang điện, tương tác yếu đến mức hàng tỷ neutrino xuyên qua cơ thể mỗi giây mà ta không hề cảm nhận được.
1.4.6 Higgs boson
Higgs boson tương tác với các hạt khác để chúng có khối lượng. Phát hiện năm 2012 tại CERN là cột mốc lịch sử.
2 PHẦN 2: PHÂN TỬ – CHẤT – TRẠNG THÁI VẬT CHẤT
2.1.1 Phân tử là gì?
Phân tử là tập hợp từ 2 nguyên tử trở lên, liên kết bằng liên kết hóa học.
2.1.2 Cấu trúc của phân tử
Phân tử có thể đơn giản như O₂, H₂; hoặc phức tạp như C₆H₁₂O₆ (glucose).
2.1.3 Đặc điểm của phân tử
Phân tử giữ nguyên tính chất hóa học của chất, tham gia phản ứng để tạo chất mới.
- (H2) 2.2 Các loại liên kết hóa học trong phân tử
- (H3) 2.2.1 Liên kết cộng hóa trị
Các nguyên tử chia sẻ electron (ví dụ: H₂O).
- (H3) 2.2.2 Liên kết ion
Nguyên tử cho – nhận electron để tạo ion trái dấu (ví dụ: NaCl).
- (H3) 2.2.3 Liên kết kim loại
Electron tự do gắn kết các ion dương, tạo nên tính dẫn điện, dẻo của kim loại.
2.2.4 Bảng So Sánh Các Loại Liên Kết Hóa Học
| Loại liên kết | Cơ chế | Ví dụ | Đặc điểm |
| Cộng hóa trị | Chia sẻ electron | H₂O | Ổn định, phân tử trung hòa |
| Ion | Cho – nhận electron | NaCl | Tạo tinh thể, tan trong nước |
| Kim loại | Electron tự do | Cu, Fe | Dẫn điện, dẻo |
2.2.5 Các liên kết yếu nhưng quan trọng
Liên kết hydro, Van der Waals – yếu nhưng rất quan trọng trong sinh học (ví dụ: cấu trúc ADN).
2.3 Đơn chất và Hợp chất
2.3.1 Đơn chất
Chất chỉ gồm một nguyên tố (O₂, Fe).
2.3.2 Hợp chất
Chất gồm từ 2 nguyên tố trở lên (H₂O, NaCl).
2.3.3 Bảng so sánh
Nguyên tử, phân tử, đơn chất và hợp chất khác nhau ở cấp độ cấu tạo.
2.3.4 Phân loại nguyên tố: Kim loại – Phi kim – Á kim
- Kim loại: dẫn điện, dẻo (Fe, Cu).
- Phi kim: giòn, dễ bay hơi (O, N).
- Á kim: tính chất trung gian (Si).
2.4 Các trạng thái của vật chất: rắn – lỏng – khí – plasma
2.4.1 Chất rắn
Có hình dạng và thể tích xác định.
2.4.2 Chất lỏng
Có thể tích xác định, hình dạng phụ thuộc vật chứa.
2.4.3 Chất khí
Không có hình dạng, thể tích xác định, dễ nén.
2.4.4 Trạng thái plasma
Là trạng thái ion hóa, tồn tại trong Mặt trời, sấm sét, đèn huỳnh quang.
2.4.5 Chuyển đổi trạng thái vật chất
Rắn ↔ Lỏng ↔ Khí ↔ Plasma, phụ thuộc nhiệt độ và áp suất.
3 PHẦN 3: PHẢN ỨNG HÓA HỌC & BIẾN ĐỔI VẬT CHẤT
3.1 Phản ứng hóa học là gì?
Phản ứng hóa học là quá trình biến đổi chất này thành chất khác bằng cách phá vỡ và hình thành liên kết hóa học mới.
3.2 Phân loại phản ứng hóa học
3.2.1 Phản ứng tổng hợp
A + B → AB
3.2.2 Phản ứng phân hủy
AB → A + B
3.2.3 Phản ứng thế (thay thế)
A + BC → AC + B
3.2.4 Phản ứng trao đổi
AB + CD → AD + CB
3.2.5 Phản ứng oxi hóa – khử
Xảy ra khi có sự cho – nhận electron.
3.2.6 Phản ứng hữu cơ
Xảy ra với hợp chất hữu cơ như hydrocacbon.
3.2.7 Tóm tắt các loại phản ứng
Bảng tổng hợp để dễ phân biệt các loại phản ứng.
3.3 Biến đổi vật chất
3.3.1 Khái niệm
Biến đổi vật chất gồm biến đổi vật lý (trạng thái) và biến đổi hóa học (cấu trúc).
3.3.2 Đặc điểm và ứng dụng
- Biến đổi vật lý: nước đá tan, hơi nước ngưng tụ.
- Biến đổi hóa học: sắt gỉ, gỗ cháy.
Ứng dụng trong luyện kim, nấu ăn, sản xuất điện năng…
PHẦN 4: VẬT CHẤT – TỪ HẠT VI MÔ ĐẾN THẾ GIỚI QUANH TA
Vật chất bắt đầu từ hạt sơ cấp như quark, gluon. Chúng tạo thành proton, neutron, rồi hạt nhân và nguyên tử. Nguyên tử kết hợp thành phân tử, phân tử tạo thành chất, và từ đó hình thành thế giới quanh ta – từ không khí, nước, cơ thể sống cho đến các vì sao xa xôi.
4 Meta SEO
Meta Title: Cấu tạo và Biến đổi Vật Chất – Giáo trình Khoa học Cơ Bản
Meta Description: Khám phá cấu tạo vật chất từ hạt quark, proton, neutron, nguyên tử đến phân tử và phản ứng hóa học. Giáo trình PDF đầy đủ, dễ hiểu, chuẩn khoa học.
Từ khóa chính: cấu tạo vật chất, nguyên tử là gì, hạt cơ bản, quark, proton neutron, electron, phân tử, phản ứng hóa học, liên kết hóa học, trạng thái vật chất
Từ khóa phụ: hạt gluon, cơ học lượng tử, hạt nhân nguyên tử, đơn chất hợp chất, plasma, oxi hóa khử, giáo trình vật lý hóa học cơ bản

